Abstract
I polmoni sono il target primario del danno tissutale da COVID-19 e per questo i rilievi polmonari post-mortem forniscono un insight cruciale per comprendere la fisiopatologia delle forme più severe.
A distanza di 2 anni dall’inizio della pandemia da SARS-CoV-2, una recentissima review pubblicata su The Lancet: Respiratory Medicine affronta il tema, spaziando dai reperti istologici di base fino alle più moderne tecnologie digitali, dimostrando ancora una volta come la patologia forense possa fornire un contributo determinante per l’avanzamento dei percorsi di cura dei pazienti (Milross L et al. Post-mortem lung tissue: the fossil record of the pathophysiology and immunopathology of severe COVID-19. Lancet Respir Med 2022;10: 95–106).
. . . .
La COVID-19 è una malattia multisistemica, ma nella maggior parte dei casi il sistema respiratorio è il target virale primario e quello che più è danneggiato dalla malattia nelle fasi avanzate.
L’accumulo di evidenze ha portato a descrivere la COVID-19 come una patologia bifasica, con la seconda fase di malattia determinata da una risposta immunopatologica sistemica.
Nel corso dell’attuale pandemia, le evidenze accumulate hanno documentato l’eterogeneità del “polmone da COVID”, ma tre quadri principali sono emersi quale espressione di distinti processi patologici a carico dell’apparato respiratorio:
- fenotipo classico, caratterizzato da un progressivo danno alveolare diffuso;
- quadro di broncopolmonite, quale risultato di una sovrainfezione secondaria;
- grave deterioramento tissutale da complicanze trombotiche.
Questi fenotipi non solo mutualmente esclusivi ma spesso di sovrappongono.
Al netto dei dati obiettivi, tuttavia, il meccanismo patologico della malattia non è stato ancora completamente chiarito. Molto di ciò che sappiamo deriva dai rilievi autoptici circa le manifestazioni polmonari ed extra-polmonari dell’infezione da SARS-CoV-2.
Infatti, l’analisi dei campioni tissutali polmonari raccolti durante l’autopsia fornisce un’istantanea che non ha eguali sul danno tissutale al momento della morte.
I campioni di tessuto polmonare possono essere analizzati con tecniche convenzionali (microscopia ottica, immunoistochimica e immunofluorescenza), ma anche con strumenti più avanzati (citometria di massa, microscopia elettronica, trascrittomica tissutale ad alta risoluzione, proteomica, digital spatial profiling).
L’RNA o le proteine di SARS-CoV-2 possono essere precisamente localizzate all’interno del tessuto mediante l’immunoistochimica, la citometria di massa, la microscopia elettronica e l’ibridazione in-situ, e questo ha permesso di documentare che il trofismo polmonare del virus è caratterizzato da eterogeneità non solo inter- ma anche intra-paziente.
Microscopia ottica
Sono numerosi gli Studi che riportano i rilievi istologici ottenuti con l’utilizzo della microscopia ottica routinaria.
In una serie di 38 autopsie di pazienti COVID-positivi deceduti in ospedali del Nord Italia, già nel 2020 Carsana e colleghi avevano identificato quale pattern istologico prevalente il danno alveolare diffuso (DAD) a carico degli pneumociti e dell’endotelio alveolare.
Lo stadio acuto (detto anche essudativo o precoce) è caratterizzato microscopicamente dalla formazione di membrane ialine, edema interstiziale ed alveolare e da setti alveolari congesti ed emorragici contenenti detriti cellulari ed infiltrato mononucleato (fig. 1A).
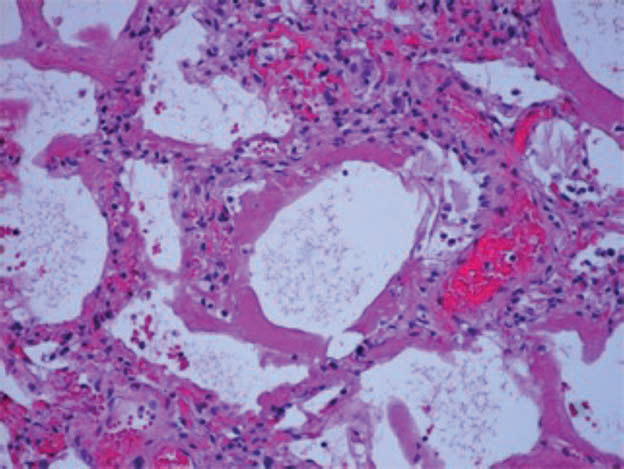
Fig. 1A: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Danno alveolare diffuso essudativo con membrane ialine, moderata infiltrazione leucocitaria mononucleata interstiziale, congestione dei setti alveolari e detriti cellulari (da Milross L et al. 2022).
I leucociti mononucleati possono infiltrare anche lo spazio perivascolare (fig. 1B).
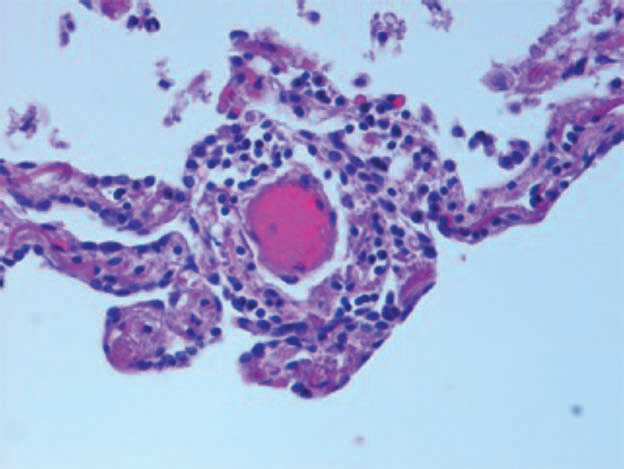
Fig. 1B: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Infiltrazione perivascolare dei leucociti mononucleati (da Milross L et al. 2022).
La fase acuta è seguita da una fase di organizzazione nella quale si assiste ad iperplasia degli pneumociti e proliferazione dei fibroblasti con deposizione settale ed alveolare di fibrina ed ispessimento settale che determinano il rimaneggiamento della normale architettura polmonare (fig. 1C).
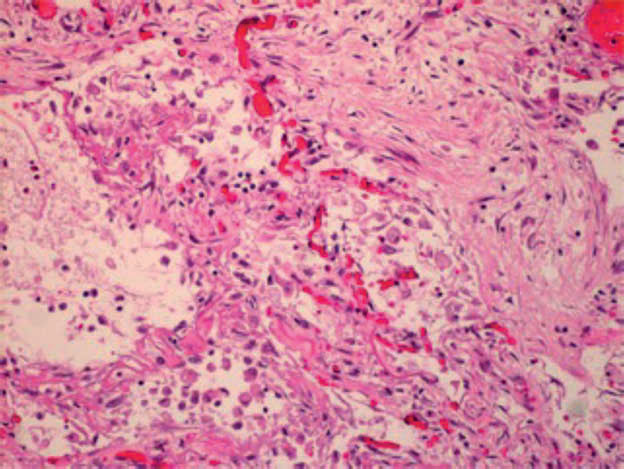
Fig. 1C: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Fase di organizzazione del DAD con proliferazione miofibroblastica, essudato fibrinoso, membrane ialine e sostanziale distruzione della normale architettura polmonare (da Milross L et al. 2022).
Tuttavia, i rilievi istologici hanno documentato altri possibili fenotipi della malattia.
Tra gli altri, Grosse e colleghi hanno confermato un quadro già descritto da una case series pubblicata all’inizio della pandemia da una équipe di Wuhan, descrivendo una serie di casi di sovrainfezione broncopneumonica acuta su COVID-19, caratterizzata da aree di suppurazione bronco-alveolare con infiltrazione neutrofila (fig. 1D).
Il rilievo fu poi documentato anche da altri gruppi di studio, con evidenza di pattern di broncopolmonite sia diffusa che focale e della possibilità che la sovrainfezione fosse ad opera, non solo di ceppi batterici, ma anche fungini.
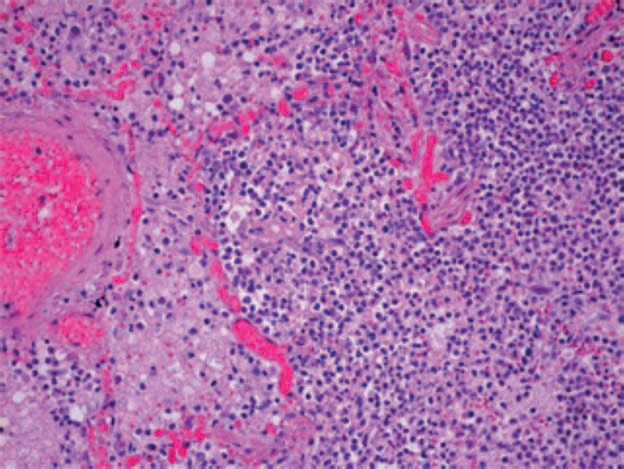
Fig. 1D: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Broncopolmonite acuta caratterizzata da infiltrazione intra-alveolare neutrofila (da Milross L et al. 2022).
Infine, una quota di casi di COVID-19 mostrano evidenze di eventi trombotici, inclusi embolia polmonare, trombosi venosa profonda, e infarto acuto del miocardio con conseguente edema polmonare cardiogeno (fig. 1E).
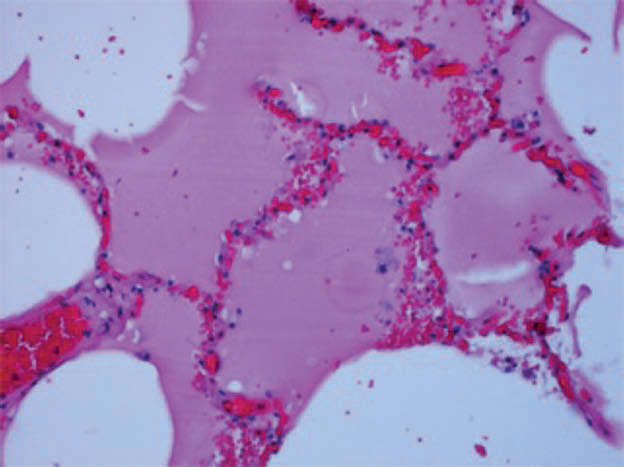
Fig. 1E: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Edema polmonare cardiogeno, caratterizzato da fluido eosinofilo endoalveolare, congestione della parete alveolare e sostanziale assenza di danno cellulare (da Milross L et al. 2022).
L’associazione tra COVID-19 e complicanze trombotiche è oggetto di intense indagini, con una prevalenza di indicatori di diatesi trombotica nei soggetti deceduti rispetto ai sopravvissuti. La presenza di fibrina e microtrombi piastrinici è stata comunemente riportata nelle istologie polmonari (fig. 1F).
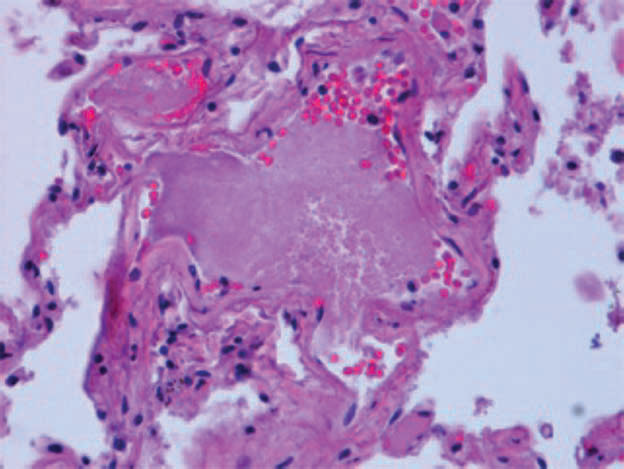
Fig. 1F: Preparato di tessuto polmonare di paziente deceduto COVID+, colorato con ematossilina-eosina. Trombo piastrinico che causa dilatazione di un piccolo vaso intra-acinare (da Milross L et al. 2022).
Immunoistochimica e Immunofluorescenza
L’utilizzo combinato dei metodi immunoistochimici e della colorazione con ematossilina-eosina ha permesso di evidenziare le differenze temporali nel danno polmonare durante la progressione della COVID-19.
Le cellule immunitarie che fungono da first-responders nelle fasi precoci sono rappresentate dai macrofagi (CD68+) e dai linfociti T (CD3+), che hanno rispettivamente distribuzione alveolare ed interstiziale.
Successivamente, la proliferazione dei fibriblasti e dei miofibroblasti porta alla deposizione di collagene e alla fibrosi.
L’immunoistochimica può, inoltre, essere utilizzata per l’identificazione di proteine, quali le citochine e le chemochine: nei tessuti di soggetti deceduti per COVID-19 è stata riscontrata una grande quantità di mediatori dell’infiammazione quali IL-6, CXCL10, TNF e IL-1β, associati ad infiltrazione cellulare leucocitaria diffusa.
Anche la coagulopatia COVID-relata è stata indagata con metodi immunoistochimici mediante i quali è stata documentata una deposizione anomala di piastrine (CD61+) nel tessuto polmonare infettato da SARS-CoV-2 rispetto ai ceppi virali dell’influenza comune.
Tali rilievi sono stati confermati da numerosi studi e sono estremamente promettenti sia al fine di comprendere meglio i meccanismi fisiopatologici della malattia sia per identificare con maggior chiarezza le cause ed i fattori contribuenti alla morte nella pratica forense routinaria.
Anche i metodi di immunofluorescenza sono di ausilio nell’accumulo delle evidenze sempre più dettagliate sulla COVID-19: sono stati con tali mezzi indagati – tra gli altri – la proteina spike di SARS-CoV-2, l’enzima di conversione dell’angiotensina 2 (ACE2), le proteine non strutturali associate alla replicazione virale (nsp13 e nsp8), il tropismo virale, l’infiltrazione infiammatoria perivascolare delle arterie di piccolo e medio calibro del polmone (caratterizzata da cellule mononucleate positive per la proteina MRP8), l’apoptosi delle cellule alveolari e vascolari.
L’auspicio è che in futuro l’approccio ai singoli casi, siano essi di interesse scientifico o forense, possa avvalersi sempre più spesso, oltre che degli strumenti convenzionali, anche di indagini ancillari più sofisticate, configurando un percorso di lavoro integrato (fig. 2).

Fig. 2: Esempio di flusso di lavoro che integra tecniche convenzionali ed avanzate nello studio del tessuto polmonare di soggetto deceduto dopo infezione da SARS-CoV-2 (da Milross L et al. 2022).
Se ciò che hai scoperto fin qui ti ha incuriosito, leggi l’articolo completo per conoscere di più sulle tecniche di indagine del danno polmonare da COVID-19.
Per confrontarci sul tema, ci vediamo a Bari dal 26 al 28 maggio 2022: “COVID e Medicina Legale” sarà infatti tra i main topics del Congresso Nazionale Simla 2022 (LINK).
VUOI APPROFONDIRE QUESTO ARGOMENTO?
Leggi anche: Congresso nazionale SIMLA: save the date