Abstract
Il Ministero della Salute riorganizza i Comitati Etici che sorvegliano sulle sperimentazioni cliniche allineandosi con le normative europee.
Ce ne parlano la Dott.ssa Lucia Tattoli – Ricercatrice Medicina Legale Università degli Studi di Torino e Dirigente Medico Città della Salute e della Scienza di Torino e Dott.ssa Barbara Abenante – Specialista in Formazione Medicina Legale Università degli Studi di Torino.
. . . .
Il 30 gennaio 2023 il Ministro della Salute, Orazio Schillaci, ha finalmente ratificato gli attesi decreti sulla riorganizzazione dei comitati etici (CE), gli organismi indipendenti la cui principale funzione e responsabilità è di valutare gli aspetti etici e scientifici delle sperimentazioni cliniche al fine di garantire e tutelare i diritti, la sicurezza e il benessere delle persone coinvolte (vedi Art. 1 Decreto del Ministero della Salute 8 febbraio 2013 “Criteri per la composizione e il funzionamento dei comitati etici”).
Il 7 febbraio 2023 sono stati quindi pubblicati in Gazzetta Ufficiale i Decreti ministeriali, in numero di quattro, previsti dall’articolo 2, ai commi 5, 7, 11 e 15, della legge 11 gennaio 2018, n. 3 “Delega al Governo in materia di sperimentazione clinica di medicinali nonché disposizioni per il riordino delle professioni sanitarie e per la dirigenza sanitaria del Ministero della salute”.
Tutto questo ha rappresentato un passo decisivo verso la definitiva stabilizzazione del quadro regolatorio delle sperimentazioni cliniche in Italia, allineandosi al Regolamento (UE) n. 536/2014 del Parlamento europeo e del Consiglio sulle sperimentazioni cliniche di medicinali per uso umano, abrogando la Direttiva 2001/20/CE già recepita nell’ordinamento italiano con il D.lgs. n. 211/2003.
.
Gli Obiettivi
Il Regolamento, entrato in vigore il 31 gennaio 2022, ha l’obiettivo di armonizzare la disciplina europea sulle sperimentazioni cliniche con un duplice fine: garantire standard elevati di sicurezza per i pazienti e semplificare le procedure di autorizzazione attraverso una collaborazione degli Stati Membri. Per cui, dal 1° febbraio 2022 tutte le domande iniziali di sperimentazione clinica nell’Unione europea (Ue) devono essere presentate tramite il nuovo sistema informativo delle sperimentazioni cliniche, il Clinical Trials Information System (Ctis). Dopo un periodo di transizione della durata di un anno, a partire dal 31 gennaio 2023 il Ctis è diventato, come dichiarato dall’EMA, “il punto di accesso unico per gli sponsor e le autorità di regolamentazione delle sperimentazioni cliniche per la presentazione e la valutazione dei dati delle sperimentazioni cliniche”. Entro il 2025 vi sarà il passaggio definitivo alle disposizioni del Regolamento per tutte le sperimentazioni in corso.
La Legge 3/2018 o Legge Lorenzin, approvata dopo un lungo iter parlamentare, aveva infatti disposto il riassetto delle norme in materia di sperimentazione clinica dei medicinali per uso umano, dando delega al Governo di adottare uno o più decreti legislativi che si armonizzassero con quanto contenuto nel Regolamento (UE) n. 536/2014.
.
La Riorganizzazione dei Comitati Etici
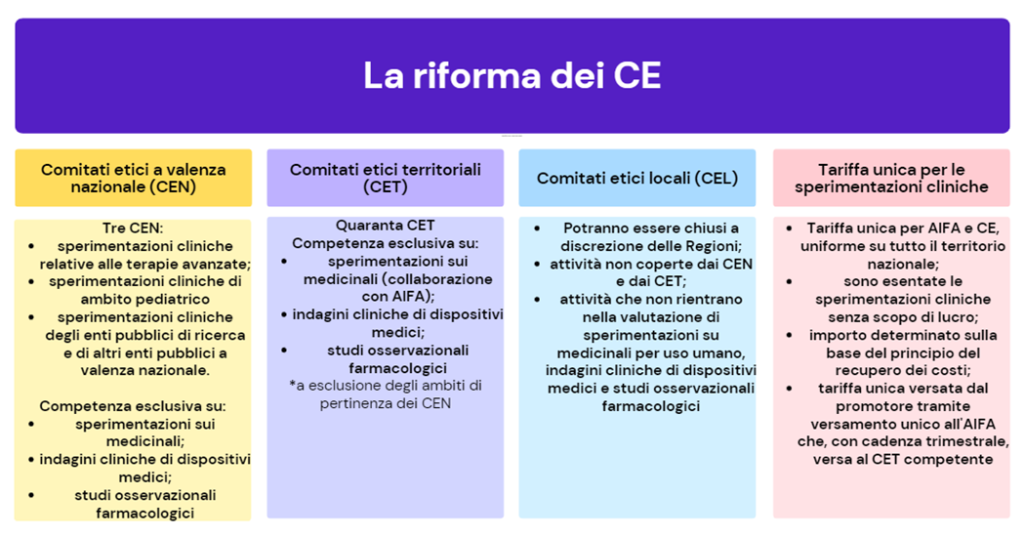
La Legge prevede una riduzione dei circa 90 CE esistenti (CE Locali o CEL), distribuiti nelle strutture sanitarie sul territorio italiano, a un massimo di 40 CE territoriali (CET) e 3 CE nazionali (CEN), solo questi ultimi istituti con DM 1° febbraio 2022 (vedi Decreto del Ministero della Salute 1° febbraio 2022 “Individuazione dei comitati etici a valenza nazionale”) e comprendenti:
- CEN per le sperimentazioni cliniche in ambito pediatrico, presso l’Agenzia Italiana del Farmaco;
- CEN per le sperimentazioni cliniche relative a terapie avanzate (Advanced Medicinal Therapeutical Products «ATMPs»), presso l’Agenzia Italiana del Farmaco;
- CEN per le sperimentazioni cliniche degli enti pubblici di ricerca (EPR) e altri enti pubblici a carattere nazionale, presso l’Istituto Superiore di Sanità.
Se ce ne fosse ancora bisogno, deve rammentarsi che la ricerca scientifica rappresenta un patrimonio inestimabile della Sanità, un elemento fondamentale per lo sviluppo e il progresso di ogni Paese, ruolo reso ancor più cogente durante la pandemia da COVID-19.
In un contesto emergenziale, così carico di incertezze, fare ricerca rappresenta un imperativo etico che però deve rispettare gli standard nella conduzione della stessa, bilanciando la necessità di ottenere delle evidenze in tempi rapidi al fine di guidare gli interventi di sanità pubblica, con la tutela degli individui e il rispetto dei principi etici della ricerca.
È quindi innegabile come l’esperienza maturata nel corso dalla pandemia abbia dato una spinta alla necessità di riorganizzare l’assetto dei Comitati Etici italiani, in ossequio al Regolamento UE n. 536/2014.
.
I Decreti Ministeriali Pubblicati in Gazzetta Ufficiale
I quattro decreti ministeriali pubblicati il 7 febbraio 2023 in G.U. sono:
- il Decreto 26 gennaio 2023 recante “Individuazione di quaranta comitati etici territoriali”, che entrerà in vigore dal 7 giugno 2023 (cosiddetto “DM 40 CET”);
- il Decreto 27 gennaio 2023 recante “Regolamentazione della fase transitoria ai sensi dell’articolo 2, comma 15, della legge 11 gennaio 2018, numero 3, in relazione alle attività di valutazione e alle modalità di interazione tra il Centro di coordinamento, i comitati etici territoriali, i comitati etici a valenza nazionale e l’Agenzia italiana del farmaco, in vigore dal 22 febbraio 2023 (“DM fase transitoria”);
- il Decreto del 30 gennaio 2023 recante “Determinazione della tariffa unica per le sperimentazioni cliniche, del gettone di presenza e del rimborso spese per la partecipazione alle riunioni del Centro di coordinamento nazionale dei comitati etici territoriali per le sperimentazioni cliniche sui medicinali per uso umano e sui dispositivi medici, dei comitati etici territoriali e dei comitati etici a valenza nazionale”, in vigore dal 22 febbraio 2023;
- il Decreto del 30 gennaio 2023 recante “Definizione dei criteri per la composizione e il funzionamento dei comitati etici territoriali”, in vigore dall’8 febbraio 2023.
.
La Suddivisione delle Competenze
Nel biennio 2022-2023 sono stati individuati i CET e CEN previsti dalla Legge Lorenzin rispettivamente in ambito del DM 26 gennaio 2023 recante Individuazione di quaranta comitati etici territoriali e del DM 1° febbraio 2022, recante Individuazione dei comitati etici a valenza Nazionale .
I CEN hanno competenza in terapia avanzate in ambiti specifici come quello pediatrico e degli enti pubblici di ricerca in relazione alle sperimentazioni sui medicinali, le indagini cliniche di dispositivi medici e gli studi osservazionali farmacologici.
I 40 CET avranno competenza nelle sperimentazioni sui medicinali (in collaborazione con Aifa), le indagini cliniche di dispositivi medici e gli studi osservazionali farmacologici, negli ambiti non coperti dai CEN.
Le Regioni potranno scegliere se mantenere o meno operativi i CEL a cui saranno demandate le attività non coperte dai CEN o CET o che non rientrano nella valutazione delle sperimentazioni sui medicinali per uso umano, nelle indagini cliniche di dispositivi medici e negli studi osservazionali farmacologici (es. valutazione delle domande di uso compassionevole, studi interventistici non con farmaco o dispositivo, osservazionali non farmacologici).
Dal 30 gennaio 2023 al 7 giugno 2023, data di entrata in vigore del DM 40 CET (DM 26 gennaio 2023), la valutazione degli aspetti di competenza del CE compresa quella del protocollo dello studio clinico, spetta al CE già individuato come Coordinatore il cui parere è unico, valido su tutto il territorio nazionale e vincolante per tutti i centri sperimentali inclusi nella domanda di autorizzazione alla sperimentazione clinica.
Gli altri decreti, senza entrare nel dettaglio, servono a determinare la tariffa unica per le sperimentazioni cliniche e la regolamentazione della fase transitoria.
Per quanto riguarda invece la commercializzazione dei dispositivi medici, il DM 30 gennaio 2023 recante Definizione dei criteri per la composizione e il funzionamento dei comitati etici territoriali prevede che la valutazione di indagini cliniche sui dispositivi medici sia di competenza esclusiva dei CET e dei CEN, così come avviene per le sperimentazioni di medicinali.
Si confermano le indicazioni per cui i CE dovranno essere indipendenti dal centro di sperimentazione, nonché le determinazioni sulla tariffa unica per le sperimentazioni cliniche.
.
.
L’Italia cerca così di mettersi al passo con le normative europee, snellendo i processi burocratici che portano all’approvazione dei progetti di ricerca, senza mai tralasciare il rispetto dei principi etici, ma soprattutto senza mai dimenticare l’obiettivo principale della ricerca: la tutela dei diritti e del benessere delle persone coinvolte, nel rispetto del principio di beneficialità della bioetica.
Qui sotto potete leggere e scaricare i documenti citati nel testo.
VUOI APPROFONDIRE QUESTO ARGOMENTO?
Leggi anche: CNB su carcere, DAT e sciopero della fame